Độc tố ốc nón có chứa hàm lượng lớn các peptide tấn công lên các kênh ion và thụ thể thần kinh khác nhau. Độc tố của các loài Conus là nguồn dược liệu tiềm năng chưa khai thác. Nhằm tìm ra các peptide hoạt tính sinh học thần kinh có tiềm năng lớn, được tách chiết từ độc tố của loài ốc nón săn nhuyễn thể, nhóm nghiên cứu thuộc Trường Đại học Nha Trang do TS. Nguyễn Bảo làm chủ nhiệm đã đề xuất triển khai thực hiện đề tài: “Nghiên cứu các peptides hoạt tính sinh học thần kinh của ốc nón săn nhuyễn thể ở vùng biển Khánh Hòa” với các nội dung và phạm vi nghiên cứu bao gồm: Đánh bắt, khai thác ốc nón Conus ở vùng biển nước sâu Khánh Hòa; Sàng lọc và phân loại học ốc nón “săn nhuyễn thể” tiềm năng lớn bằng hình thái và di truyền; Giải phẩu tuyến nọc độc, trích li và thu nhận độc tố thô ở dạng bột đông khô; Phân đoạn, phân lập peptide trong hỗn hợp nọc độc thô trên hệ thống sắc ký lỏng hiệu năng cao-pha đảo (RP-HPLC) bằng cột C18 với chương trình gradient của dung môi acetonitrile; Sàng lọc sơ bộ hoạt tính sinh học tiềm năng của các phân đoạn thô trong nọc độc trên các động vật khác nhau (cá, nhuyễn thể, chuột); Xác định khối lượng phân tử, số lượng cysteine của các peptide tiềm năng bằng khối phổ MALDI TOF MS hoặc nanoESI-MS; Tinh sạch peptide tiềm năng bằng sắc ký lỏng hiệu năng cao-pha đảo (RPHPLC) bằng cột phân tích C18 và giải trình tự peptide tiềm năng bằng tổ hợp các phân tích MALDI TOF MS/MS, nanoESI MS/MS, Edman’s degradation và cộng hưởng từ hạt nhân.
Nhóm nghiên cứu đã lặn biển bằng bình khí nén và khai thác ốc nón Conus trưởng thành (thường có chiều dài vỏ ốc ≥60 mm, tùy thuộc từng loài) ở độ sâu hơn 10 m tại vịnh Nha Trang và vịnh Vân Phong thuộc tỉnh Khánh Hòa. Ốc được bảo quản vận chuyển sống về đến phòng thí nghiệm của Viện Công nghệ sinh học và Môi trường của Trường Đại học Nha Trang. Tại đây, ốc được phân loại sơ bộ về hình thái và được bảo quản ở -80ºC. Triển khai phân loại các loài ốc nón săn nhuyễn thể ở vùng biển Khánh Hòa dựa trên phân loại về hình thái học (theo Manual of the living Conidae, Röckel, D et al.,1995) hoặc/và phân loại theo di truyền học (theo GenBank). Tiếp đó, ốc được giải phẩu để lấy tuyến độc, được cắt nhỏ và ngâm chiết nhiều lần bằng dung dịch đệm chứa 0,1% axit trifluoroacetic (TFA) và 5% acetonitrile (ACN). Tất cả dịch chiết tuyến độc của từng loài ốc nón được gom lại đem đi đông khô và bảo quản ở -20 ºC. Tiếp đến là phân đoạn và tách chiết peptide bằng sắc ký lỏng hiệu năng cao trên cột C18 (RP-HPLC). Độc tố thô hòa tan trong dung dịch 0,1% TFA. Dịch độc tố được tách chiết, phân đoạn trên hệ thống sắc ký lỏng hiệu năng cao-pha đảo lần lượt với 2 loại cột semi-preparative C18 (300 Å, 5mm, 10 mm i.d. x250 mm) và cột phân tích C18 (300Å, 5mm, 4.6mm i.d. x 250mm) với các chương trình gradient thích hợp. Định vị peptide ở bước sóng 220 nm và rửa giải trong dung dịch đệm A (1000mL H2O/1 mL TFA) và dung dịch đệm B (900 mL ACN/100 mL H2O/1 mL TFA). Các phân đoạn được thu lại và tích lũy trong ống tube 15 mL hoặc 50 mL để đi đông khô, bảo quản hoặc đi tinh sạch hoặc đi kiểm tra hoạt tính. Sàng lọc các phân tử tiềm năng bằng phương pháp kiểm tra sơ bộ hoạt tính sinh học trên động vật (cá, ốc biển, chuột). Dung dịch muối sinh lí ứng với từng loại động vật được chuẩn bị, ví dụ với chuột thì chuẩn bị dung dịch sinh lí Krebs-Ringer (với thành phần mM: 154 NaCl, 5 KCl, 2 CaCl2, 1 MgCl2, 11 glucose and 5 HEPES, pH 7.4). Các phân đoạn độc tố (đã được định lượng proteine) hoà tan trong dung dịch sinh lí tương ứng của từng loài động vật và tiêm ở bộ phận cơ chân (với ốc biển), vùng bụng (cá, chuột) và vùng não (chuột). Hiệu ứng sinh học được quan sát và đánh giá mức độ gây độc thần kinh trên động vật. Biến tính hóa học peptide bằng phương pháp khử và alkyl hóa của các cầu nối disulfide để giải trình tự peptide tiềm năng. Các peptide chứa cầu nối SS được tiến hành khử bằng 20 mM tris-2- carboxyethyl-phosphine (TCEP) trong dung dịch đệm 0.5 M N-(2-hydroxyethyl) piperidine-N’-2-ethanesulfonic acid (HEPES) ở nhiệt độ phòng trong 30 phút. Tiếp đó tiến hành alkyl hóa bằng 50 mM iodoacetamide (IAA), để trong bóng tối 20 phút. Mẫu được khử muối bằng dụng cụ cột ZipTip C18 để đi lấy thông tin khối lượng phân tử, số lượng cysteine và giải trình tự peptide. - Đo khối lượng phân tử và giải trình tự peptide bằng MALDI TOF/TOF MS và MS/MS hoặc bằng ESI-MS và MS/MS. Phân tích bằng phương pháp ion hóa (MALDI)
Phân tử peptide được phân tích bằng máy đo khối phổ 4800 MALDI TOF/TOF™ Analyzer. Mẫu phân tích hòa trộn với dung dịch axit cyano-4- hydroxycinnamic 4 mg/mL và được đo ở chế độ tích điện dương. Thí nghiệm giải trình tự peptide bằng MS/MS, peptide được gia tốc ở 8 keV và phân mảnh MS/MS được yêu cầu va đập ở mức năng lượng 2 keV với áp suất gas 3.5x10-6 Torr. Kết quả MS, MS/MS của peptide được phân tích và giải trình tự axit amin trên phần mềm Data Explorer 4.9 (AB Sciex). Phân tích nano ESI-MS và MS/MS - peptide có hoạt tính quan trọng sẽ được kiểm tra khối lượng phân tử chính xác trên hệ thống đo khối phổ LTQ Orbitrap trang bị nguồn nano-electrospray (Thermo Scientific). Một vài microlit mẫu sẽ được nạp vào bộ phát borosilicate kẽm (Thermo Scientific). Mức năng lượng 1,2 kV được cài đặt cho bộ phát và kết quả được theo dõi trên phân mềm orbitrap với độ phân giải lý thuyết của 30.000 tại m/z 400. Đối với MS2 và MS3, năng lượng va chạm ở mức 36 eV được áp dụng. Phổ khối được xử lí bằng phần mềm Xcalibur 2.1, các ion đa điện tích được tính toán lại về dạng đơn điện tích bằng phần mềm Xtract (Thermo Scientific). Giải trình tự peptide bằng phương pháp hóa học Edman’s degradation. Mẫu peptide tinh sạch được hòa tan trong dung dịch đệm A. Một vài µL peptide chưa biến tính được nạp và giải trình tự hóa học theo chương trình chuẩn bằng hệ thống Procise® protein sequencing system (Model 492, Applied Biosystem, Foster City, CA, USA). Tinh sạch peptide tự nhiên tiềm năng từ nọc độc (RP-HPLC) hoặc tổng hợp peptide (Fmoc) dựa trên kết quả giải trình tự amino acid. Phân đoạn độc tố có hiệu ứng sinh học được tinh sạch trên cột phân tích C18 (300Å, 5mm, 4.6mm i.d. x 250mm) với nhiều chương trình gradient khác nhau của dung dịch đệm B, đông khô và được lặp đi lặp lại nhiều lần để thu được peptide tinh sạch và đồng nhất.
Kết quả của nghiên cứu đạt được như sau:
- Đã thu được 2 cơ sở dữ liệu phổ khối MALDI-TOF MS (của phân đoạn 1 phút được phân tách từ phương pháp sắc ký lỏng pha đảo) của nọc độc của 2 loài ốc nón săn nhuyễn thể quí hiếm, cụ thể là Conus marmoreus và Conus bandanus. Dữ liệu này được ghi nhận lần đầu tiên trên 2 loài ốc ở vùng biển Việt Nam. Kết quả bước đầu này làm cơ sở để phục vụ cho những nghiên cứu chuyên sâu hơn về cấu trúc phân tử trong tương lai. Bên cạnh đó, kết quả khẳng định lại là không nên khai thác loài ốc nón Conus quý hiếm này trong mục đích sử dụng như là thực phẩm vì có thể bị trúng độc cấp tính nếu chưa được nấu chín.
- Đã thu nhận được các peptide tiềm năng, được bảo quản âm sâu (-80 °C) phục vụ cho những nghiên cứu chuyên sâu về cấu trúc và cơ chế hoạt động.
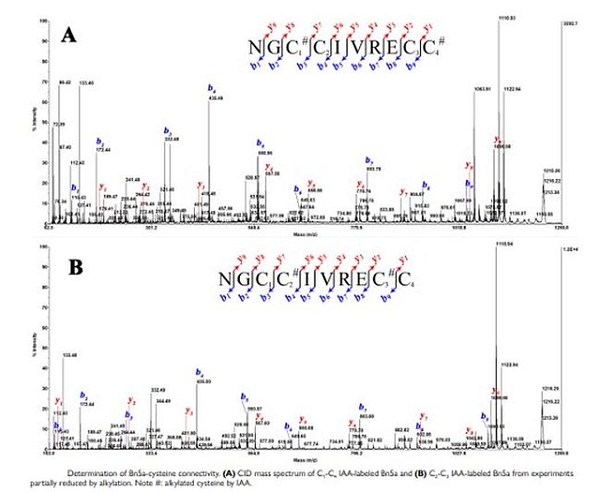
+ Nhóm nghiên cứu đã xác định được cấu trúc 6 phân tử conotoxin mới hoàn toàn, trong đó: Nhóm đã tìm ra 01 phân tử conotoxin nhỏ, chỉ có 10 amino acid trong đó chứa 4 cysteine (2 cầu liên kết disulfide), được đặt tên là Bn5a, thuộc liên họ Tconotoxin. Sau khi phân tích tính đồng dạng của phân tử peptide, nhóm xác định phân tử thuộc phân họ T1-conotoxin, với bộ khung cystein V(-CCCC-). Mặc dù phân tử Bn5a có bộ khung cystein V, tuy nhiên 2 liên kết disulfide của phân tử được xác định là khác hoàn toàn với các phân tử có cùng bộ khung được ghi nhận trước đó. Đây là hiện tượng lần đầu tiên được ghi nhận trong họ T-conotoxin, và là điều làm nên điểm đặc biệt của phân tử Bn5a và cũng đã phát hiện nhóm 05 phân tử conotoxin mới chứa 6 cysteine (3 cầu liên kết disulfide), được đặt tên là Bn3b, Bn3c, Bn3d, Bn3e, Bn3f thuộc liên họ M-conotoxin. Sau khi phân tích tính đồng dạng của phân tử peptide, nhóm đã xác định phân tử Bn3b, Bn3c, Bn3d thuộc phân họ M1- conotoxin, với bộ khung cystein III (-CC-C-C-CC-). Trong khi đó, Bn3e, Bn3f thuộc phân họ M2-conotoxin.
Có thể tìm đọc toàn văn Báo cáo kết quả nghiên cứu của Đề tài (Mã số 18072/2020) tại Cục Thông tin khoa học và công nghệ quốc gia.